2024年10月23日,太行本草研究院师生在科研楼202会议室开展组会学习,本次由2023级硕士研究生任贤芳进行“丹参饮颗粒通过Akt/Nrf2信号通路抑制氧化应激和细胞凋亡改善乙醇诱导的大鼠胃粘膜损伤”文献精读。

背景介绍
胃溃疡(GU)是一种常见的胃肠道疾病,具有高发病率,可能由多种致病因素引起。因此本作者使用三种不同的动物模型评估丹参饮(DSY)颗粒在GU中的药效学,并探索其潜在机制。通过高效液相色谱(HPLC)对DSY颗粒进行制造和质量控制,并使用乙醇、阿司匹林或水浸束缚结合阿司匹林建立三种GU模型。结果表明,DSY颗粒显著降低了三种GU模型中的GU指数和胃粘膜损伤,特别是在乙醇诱导的GU模型中,其抑制率优于奥美拉唑(60.32% vs. 21.96%)。DSY颗粒通过增加防御因子水平、降低攻击因子水平、抑制氧化应激和炎症反应以及抑制凋亡来减轻胃粘膜损伤。网络药理学和分子对接研究表明,DSY颗粒的作用机制可能与Akt信号通路有关。进一步研究发现,DSY颗粒通过降低p-Akt/Akt比例,促进Nrf2和NQO1表达,保护胃粘膜。结论表明,DSY颗粒对由不同机制引起的GU具有保护作用,尤其是对乙醇诱导的GU,通过抑制氧化应激减轻胃粘膜损伤。
结果与讨论

图1:A:标准品B:样品(HPLC色谱图中从左到右的7个峰分别为丹参素、原儿茶醛、咖啡酸、迷迭香酸、石精酸、丹酚酸A和丹酚酸B
参考标准品和DSY颗粒的HPLC色谱图,其保留时间被有效分离,且DSY颗粒的精密度、重复性、特异性、回收率试验、含量测定、系统适应性、中间精密度、检测和定量限以及耐久性结果均在标准品范围之内。实验结果说明DSY颗粒可以用于后续的实验。
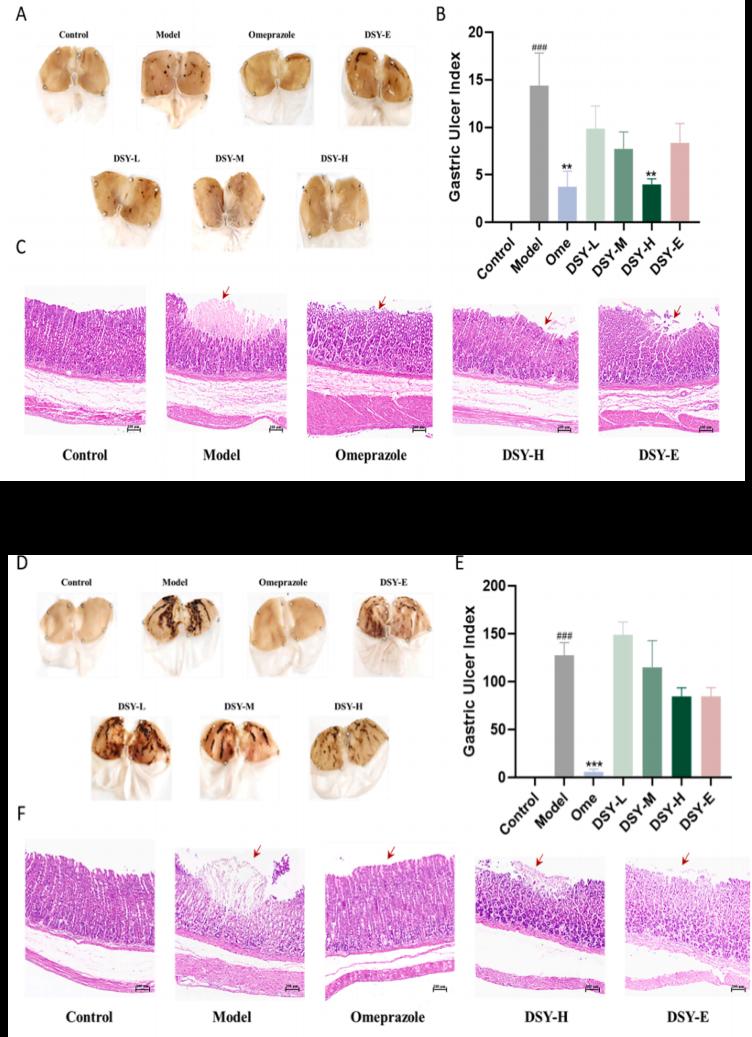
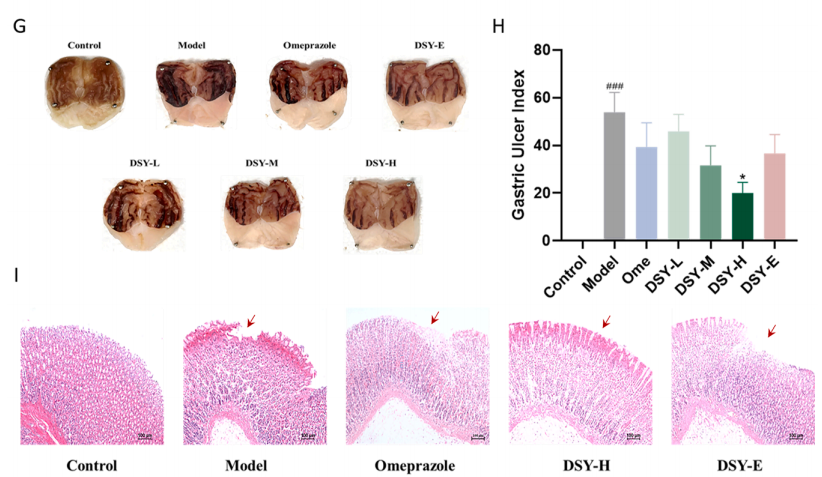
图2丹参饮颗粒3种GU模型
图2: DSY颗粒3种GU 模型。((A)阿司匹林诱导的 GU 的模型图。(B)阿司匹林诱导的 GU 指数。(C)阿司匹林诱导的 GU 的 HE 染色。(D)水浸约束联合阿司匹林诱导的 GU 的模型图。(E)水浸约束联合阿司匹林诱导的 GU 指数。(F)水浸约束联合阿司匹林诱导的 GU 的 HE 染色。(G)乙醇诱导的 GU 的模型图。(H)乙醇诱导的 GU 指数 (I)乙醇诱导的 GU 的 HE 染色。数据表示为 SEM ±平均值 (n = 6-9)。棒 = 100 μm。###p < 0.001 vs. 对照组,***p < 0.001,**p < 0.01,*p < 0.05 vs. 模型组)
作者采用三种造模方法来评估DSY颗粒的疗效其中图A中M组有明显的胃粘膜损伤。DSY-H 组和 Ome 组的胃损伤显著低于M。图B表示定量 GU 指数显示 DSY 随着剂量的增加而减小粘膜病变的大小。其中定量GU 抑制率分别为 72.17% 和 73.91%.图D中C组未发生溃疡,而M组表现为严重的出血性胃粘膜损伤。图E中与M组相比,Ome和 DSY-H 分别降低了 GU 指数分别为95.30% 和 33.66%。图 C与F中均显示C组未观察到组织学变化,而M组观察到胃明显损伤和水肿,腺体减少,炎症细胞浸润粘膜层。DSY -H和Ome明显改善了这些改变图G:显示在乙醇诱导的 GU 大鼠模型中,C组未观察到溃疡性改变,但M组中有严重的胃粘膜损伤。图H:定量 GU 指数表明 DSY-H组胃损伤的严重程度显著低于模型组。DSY-H组GU 抑制率为 62.89 %,优于奥美拉唑 (27.01 %)图I:在C组的胃切片中未观察到组织学变化;胃粘膜和肌层完好无损。在M组中观察到胃壁损伤和水肿,伴有粘膜层腺体减少和炎性细胞浸润。与模型组相比,DSY 颗粒处理会减少了粘膜损伤和水肿。DSY-H 组腺体结构丧失胃粘膜损伤较轻,优于 Ome 组。通过比较DSY颗粒 在 3 种不同模型中的效果,发现 DSY 颗粒在阿司匹林诱导的 GU 模型中与Ome具有相似的效果,但在水浸式约束联合阿司匹林诱导的 GU 模型中DSY颗粒效果不如Ome,在乙醇诱导的 GU 模型中DSY颗粒效果优于奥美拉唑。由于 DSY 颗粒在治疗乙醇诱导的 GU 方面表现出更大的疗效,因此本文将在乙醇诱导的 GU 模型中进一步探索了它们的潜在机制。
DSY颗粒保护胃粘膜糖蛋白并促进乙醇诱导的 GU 中防御因子的释放

图3:DSY 颗粒对乙醇诱导的 GU 模型中胃粘膜糖蛋白和防御因子释放的影响。干预后,PAS 染色检测胃粘膜中糖蛋白(A)测量胃组织中 PGE2 水平(B)和血清(C)中的 NO 水平作为防御因素。数据表示为 SEM ±平均值 (n = 5-6)。棒 = 100 μm。###p < 0.001 vs. 对照组,***p < 0.001,**p < 0.01,*p < 0.05 vs. 模型组。
由图A可知C组胃粘膜糖蛋白完整,呈强烈的粉红色,M组未见粉红色,表明胃粘膜糖蛋白受到乙醇的严重破坏。DSY-H 组胃粘膜糖蛋白颜色明显较深,Ome 组呈浅粉红色,表明 DSY-H 颗粒在乙醇诱导的 GU 中效果优于Ome。由图B、C可知与C组相比,M组PGE2和NO水平显著降低。DSY-H 和Ome干预后会增加胃组织PGE2与血清中NO的水平。
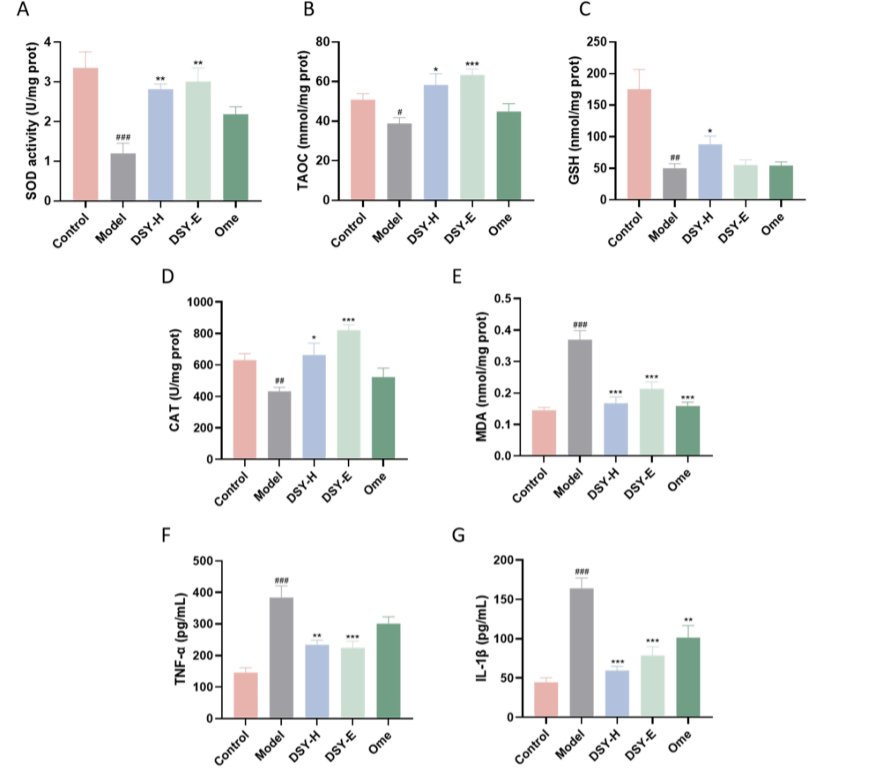
图 4.DSY 颗粒对乙醇诱导的 GU 模型中侵袭因子释放的影响。干预后检测胃组织中 SOD (A) 、TAOC (B)、GSH (C)、CAT (D)、MDA (E)、TNF-α (F) 和 IL-1β (G) 水平,评价 DSY 颗粒对氧化应激和炎症的影响。数据表示为 SEM ±平均值 (n = 5-6)。###p < 0.001, ##p < 0.01, #p < 0.05 vs. 对照组, ***p < 0.001, **p < 0.01, *p < 0.05 vs. 模型组。
如图A-E所示,与C组相比,M组胃组织中SOD、TAOC、GSH 和 CAT 水平显著降低,MDA 水平显著升高,DSY-H 明显恢复了 SOD、TAOC、GSH、CAT 和 MDA 的水平,而DSY-E和Ome部分恢复了这些指标。如图F、G中与C组相比,M组胃组织中 TNF-α和 IL-1β 水平显著增,DSY-H 显著降低 TNF-α 和 IL-1β 水平。
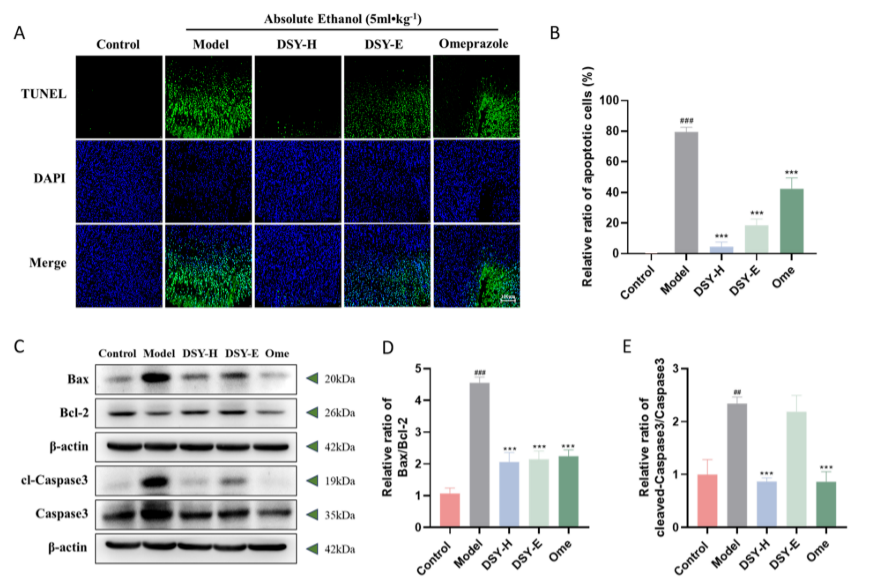
图5:western blot 检测 GU 大鼠胃组织细胞凋亡程度。(A) TUNEL 染色的代表性图像。(B) 凋亡细胞的相对比率。(C) 细胞凋亡相关蛋白的代表性图像。Bax/Bcl-2 (D)和cl-Caspase3/Caspase3(E)的相对比率。数据表示为 SEM ±平均值(n=5)。棒 = 100μm。###p < 0.001, ##p < 0.01 vs. 对照组, ***p < 0.001 vs.模型组。
图5中图A、B:Control组胃粘膜的凋亡细胞较少,而M组有大量凋亡细胞,DSY-H 、DSY-E和Ome 凋亡细胞的相对比例显著降低,表明DSY 颗粒抑制细胞凋亡。图C、D、E:M组大鼠Bax/Bcl-2和cl-Caspase-3/Caspase-3的比例分别显著增加,在DSY颗粒或Ome处理够后显著降低。
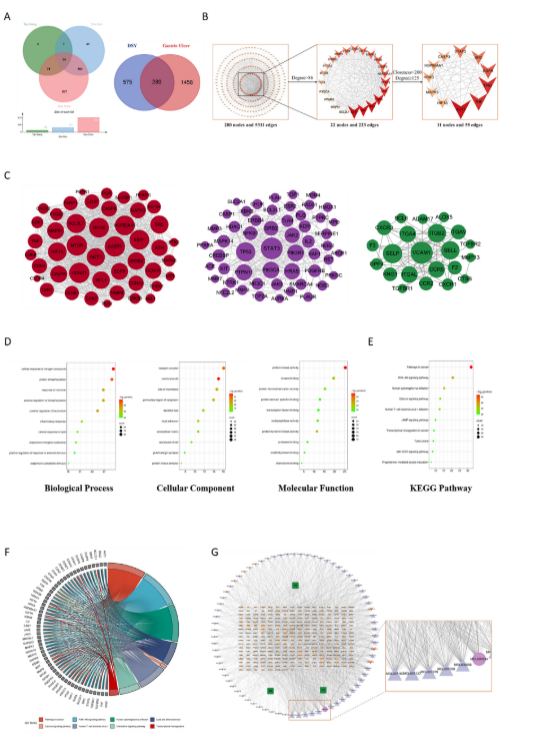
DSY对GU的网络药理学分析
图6:DSY 对 GU 的网络药理学分析。进行网络药理学分析,探讨 DSY 对 GU 的潜在靶点和活性成分。(A) DSY 与 GU 靶标的维恩图。(B) PPI 核心网络筛查流程图。(C) PPI 网络的 MCODE 图。(D) GO 富集分析的生物过程、细胞成分、分子功能。(E) KEGG 富集分析的途径。(F) 主要靶标和 KEGG 通路的 KEGG 弦。(G) 药物成分-靶点网络。
图6中共筛选出DSY的78种成分为生物活性成分,其中丹参60种成分,檀香3种成分, 砂仁15种成分。使用SwissTargetPrediction获取113个檀香靶点、260个砂仁靶点以及预测了 810 个丹参靶点(图 6A)。对上述靶点进行去重后,确定了855 个DSY 治疗靶点。从GeneCards 数据库中收集了1651个GU 疾病靶标,135 个来自DisGeNET,62 个来自 Drugbank,50 个来自CTD,19 个来自PharmGkb,7 个来自TTD。通过合并从上述数据库获得的疾病靶点并去除重复项,共预测了1738 个疾病靶点。图6A 中的Venn 图显示,进一步分析了 DSY 的 280 个潜在的 GU 相关治疗靶点。为了探索 DSY 对 GU 保护作用的潜在机制,我们将280个潜在的治疗靶点导入STRING 数据库,并使用Cytoscape 软件构建了 PPI 网络,包括 280 个节点和5311个边缘。然而,由于初步网络中的目标太多,我们进一步提取了中位数(度> 86)的目标,构建了一个由22个节点和 223 条边组成的核心网络(图 5B),22 个核心靶点列于补充表 12 中。前11个目标被筛选为中心网络。AKT1、TNF、TP53、EGFR、SRC、STAT3、CASP3、HSP90AA1、HRAS 、MAPK3 和HIF1A被预测为关键靶点,呈降序值。为了进一步预测DSY 对抗 GU 的机制,我们使用Cytoscape 软件中的MCODE 插件进行了聚类分析。280 个潜在的治疗靶点富集在 12 个簇中,MCODE 得分最高的前三个簇如图6C所示。使用Metascape 平台,进行GO和KEGG通路富集分析,以确定哪些 GU 相关生物过程和信号通路可能受 DSY 影响。前10 个富集的 BP、MF 和 CC 术语在图 5D 中以气泡图表示。5 个高度富集的 BP 术语是细胞对氮化合物的反应、蛋白质磷酸化、激素反应、磷酸化的正调节和运动的正调节。最丰富的 CC 术语是受体复合物、膜筏、膜侧、细胞质的核周区域和树突状树。基于MF富集分析,蛋白激酶活性、激酶结合、蛋白同源二聚化活性、蛋白结构域特异性结合和转录因子结合显著富集。此外,根据 KEGG 通路富集分析的基因计数和 p 值富集了前 10 条通路(图 6E)。节点的大小和颜色代表相应通路中靶标的基因计数和p值。KEGG 通路富集分析表明,靶点在以下途径中显著富集:癌症、PI3K-Akt 信号传导、人巨细胞病毒感染、钙信号传导、人T 细胞白血病病毒1感染、cAMP 信号传导和JAK-STAT 信号通路。其中,PI3K-Akt 信号通路最为丰富,表明DSY的抗GU 治疗作用可能与PI3K-Akt信号通路相关。为了进一步评估核心基因和通路之间的关系,生成了KEGG 富集分析的和弦图(图 6F),揭示了主要治疗靶点与KEGG 通路之间的关系。为了更好地了解药物、成分和靶点之间的关系,药物-成分-靶点网络,其中包括358构建了节点(280 个靶点、75 种化合物和3种药物)和1852个边缘,以阐明DSY 的生物活性成分如何防止GU(图 6G)。外圈由生物活性成分组成,按度值降序排序,三角形代表丹参的成分,菱形代表砂仁的成分,椭圆代表檀香的成分。


图 7.DSY颗粒与靶标的分子对接。进行分子对接以阐明活性成分与关键靶点的结合活性。(A) 前6个组分与Akt的分子对接。(B) 奥美拉唑与前6个靶点的分子对接。(C) MOL007050 与前6个靶点的分子对接。
表 2 前6种化合物和前6个靶点的奥美拉唑的 LibDock 评分和 CDocker 交互能
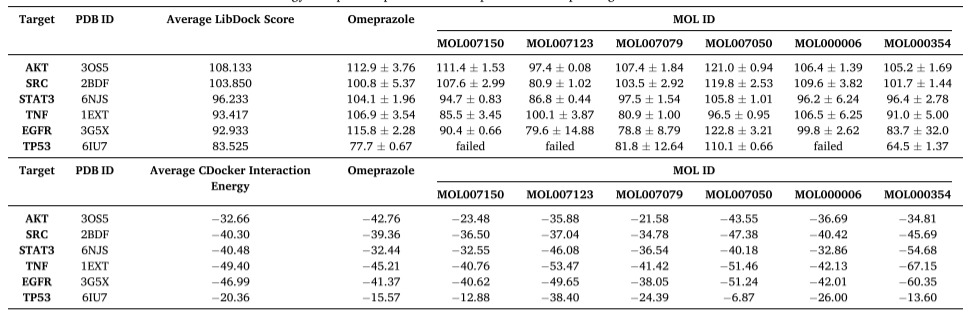
考虑 OB 和 DL,预测>度 48、MOL007150、MOL007123、MOL007079、MOL007050、MOL000006 和 MOL000354 的前 6 个成分是 DSY 发挥治疗效果的关键成分,这可能是 DSY 治疗 GU 的物质基础。为了进一步验证 DSY 治疗 GU 的疗效,在活性成分和关键靶点之间进行了分子对接。集线器网络的前六大目标是 AKT、TNF、TP53、EGFR、SRC 和 STAT3。通过分子对接验证前 6 个组分与这些靶点的结合活性;AKT 、 SRC 、 STAT3 、 TNF 、 EGFR 和 TP53 的平均 LibDock 分数和 CDocker 交互能量如表 2 所示。分子对接结果显示,AKT 在关键靶点中平均 LibDock 评分最高。图 7A 说明了前 6 个配体与 AKT 的 3D 和 2D 图以及配体相互作用。图 7B 说明了奥美拉唑对六个靶标的 3D 和 2D 图以及配体相互作用。奥美拉唑的 LibDock 评分分别为 AKT 、 SRC 、 STAT3 、 TNF 、 EGFR 和 TP53 的 112.9 、 100.8 、 104.1 、 106.9 、 115.8 和 77.7。MOL007050与前六个靶点的结合亲和力最好,AKT、SRC、STAT3、TNF、EGFR 和 TP53 的 LibDock 评分分别为 121.0、119.8、105.8、96.5、122.8、110.1,CDocker 相互作用能分别为 -43.55、-47.38、-40.18、-51.46、-51.24 和 -6.87。MOL007050 与前 6 个靶标的 3D 和 2D 图以及配体相互作用如图 7C 所示。MOL007050主要通过常规氢键、碳氢键和 π-阴离子与前 6 个靶标的氨基酸残基相互作用。这些结果表明,AKT 可能是 DSY 的关键靶点,MOL007050可能是 DSY 治疗 GU 的主要活性成分。
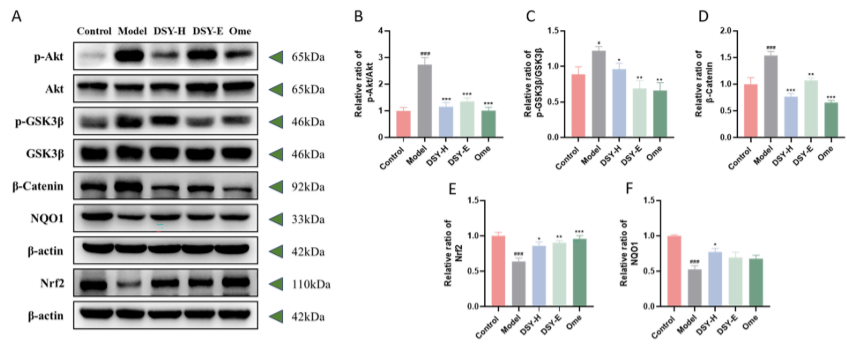
图8:DSY 颗粒对乙醇诱导的 GU 模型中 Akt/Nrf2 信号通路的影响。Western blot 检测 GU 大鼠 Akt/Nrf2 信号通路相关蛋白的表达。(A) Akt/Nrf2 信号通路相关蛋白的代表性图像。p-Akt/Akt (B)、p-GSK3β/GSK3β (C)、β-连环蛋白 (D)、Nrf2 (E) 和 NQO1 (F) 的相对比率。数据表示为 SEM ±平均值 (n = 4-5)。###p < 0.001,#p < 0.05 vs. 对照组,***p < 0.001,**p < 0.01,*p < 0.05 vs. 模型组。
图8中A-D结果显示,M组大鼠胃组织中Akt和p-GSK3β的磷酸化水平以及β-Catenin的表达均高于C组,DSY-H显著降低p-Akt/Akt、p-GSK3β/GSK3β的比例和β-Catenin的表达。图E、F结果表明,M组胃组织中Nrf2和NQO1的表达显著低于C组,DSY-H可以恢复Nrf2和NQO1的表达。
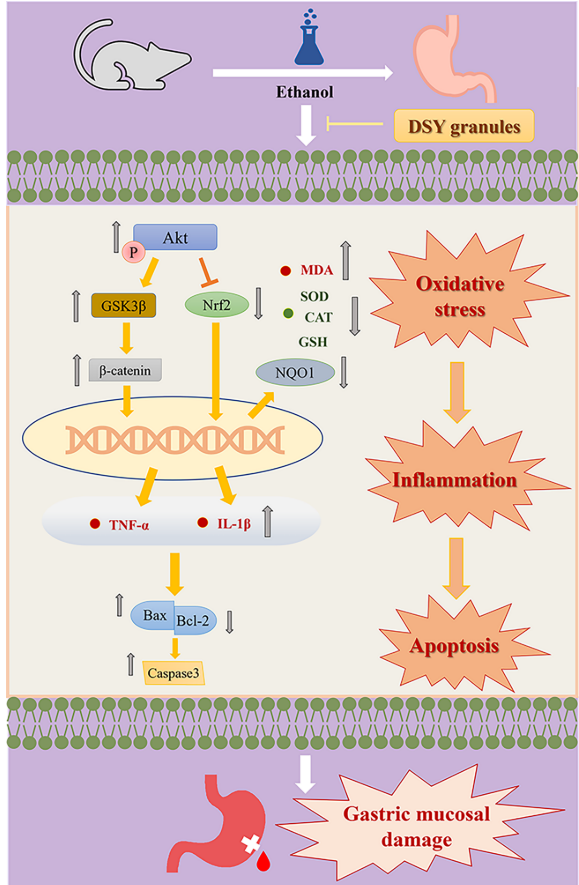
图9 DSY 颗粒减轻乙醇诱导的 GU 的示意图
总结
综上所述,结果证明 DSY 颗粒对不同的 GU 模型产生保护作用,尤其是乙醇诱导的 GU,其机制可能与通过调节 Akt/Nrf2 信号通路抑制氧化应激、炎症反应和细胞凋亡有关。本研究可能为 DSY 颗粒作为治疗GU 的的药物的开发奠定理论和实验基础。