2024年11月6日,太行本草研究院师生在科研楼202会议室开展组会学习,本次由2023级硕士研究生刘连梅进行“五味子木脂素通过介导神经炎症-TRPV1在小胶质细胞中的表达抑制帕金森病的进展”文献精读。

背景介绍
帕金森病(PD)是神经病学领域公认的退行性神经系统疾病, 帕金森病目前被认为是一种影响多个系统的复杂疾病,其特征是显著的神经炎症。神经炎症在保护神经元免受伤害和减轻神经元损伤方面起着关键作用,其中涉及小胶质细胞等免疫细胞, 活化的小胶质细胞有两种主要表型:M1表型分泌促炎化学物质,可引起神经毒性;而M2表型作为抗炎反应,有助于神经保护和组织再生,发挥神经保护作用。因此,小胶质细胞M1向M2表型的快速转化被认为是治疗神经炎症相关疾病的可行方法。TRPV1存在于小胶质细胞膜上,已被认为是神经退行性疾病中神经保护的可能靶点。TRPV1是一种非选择性阳离子通道,在PD中受影响的区域(纹状体和黑质)中表达,对钙离子具有高度渗透性,被认为是大多数神经退行性疾病中神经炎症的分子开关。
结果与讨论
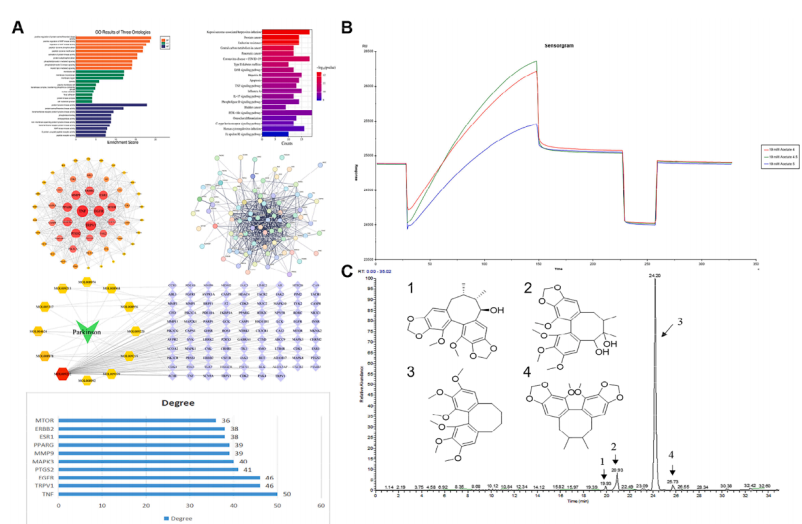
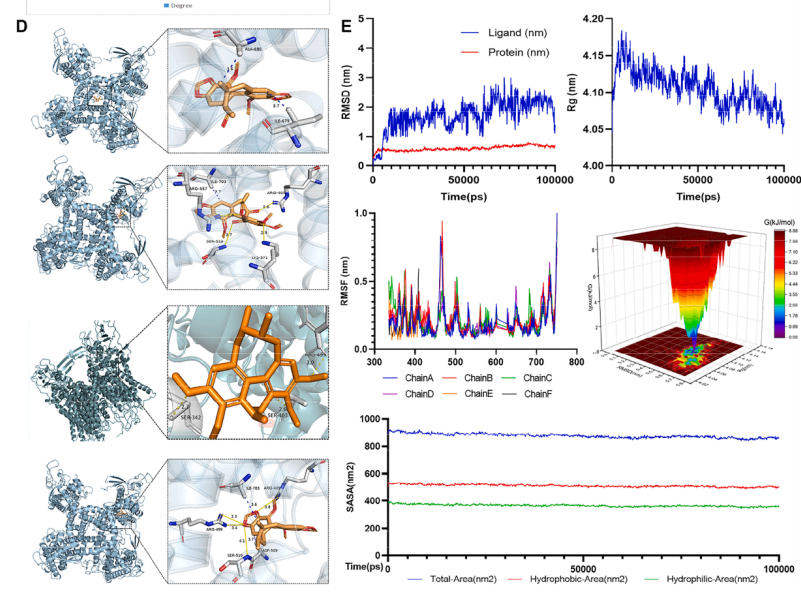

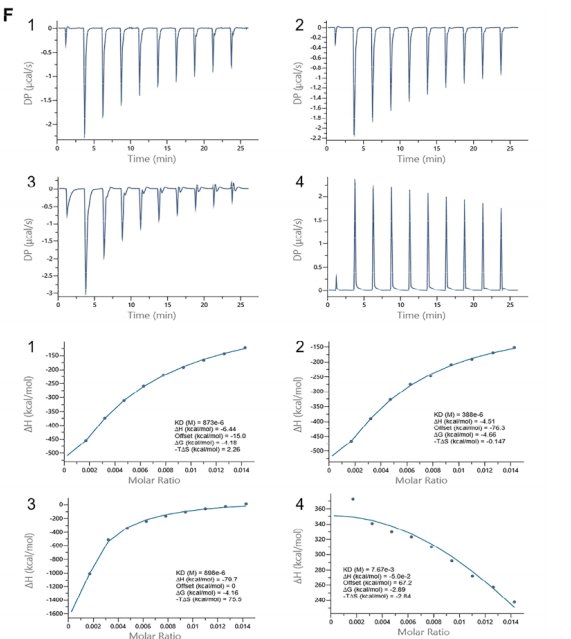
图1 (A)主要生物活性化合物与PD相关基因之间可能存在的相互作用;(B-C)经SPR实验发现主要有效成分;(D)典型化合物与蛋白TRPV1的直接相互作用,通过分子对接模拟显示;(E) Gomisin R与TRPV1的分子对接研究及MD模拟;(F) TRPV1活性成分的ITC检测;(G) TRPV1活性成分的SPR测定
作者利用网络药理学找到五味子木脂素提取物和PD的潜在靶点,并对这些交集靶点做蛋白-蛋白互作网络,找到最关键的12个靶标TNF、TRPV1、PPARG、EGFR、PTGS2、mTOR、JAK2、ESR1、ERBB2、MDM2,同时通过KEGG/GO通路富集得到相关通路,选择TRPV1为目标靶点。通过分子对接及SPR、ITC检测木脂素提取物与目标靶点的结合能力。同时采用液质联用的方法在化合物数据库检索得到4个检测组分,分别为:gomisin R(峰1),gomisin P(峰2),脱氧五味子甲素(峰3)和五味子甲素C(峰4)对富集成分LSC进行成分指认,共指认出化合物36个。后续对典型化合物与目标靶点进行分子对接及动力学模拟,SPR检测获得相应结合能。
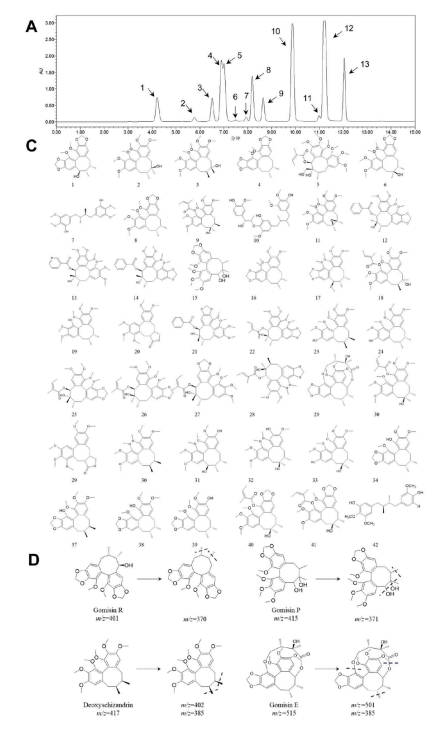
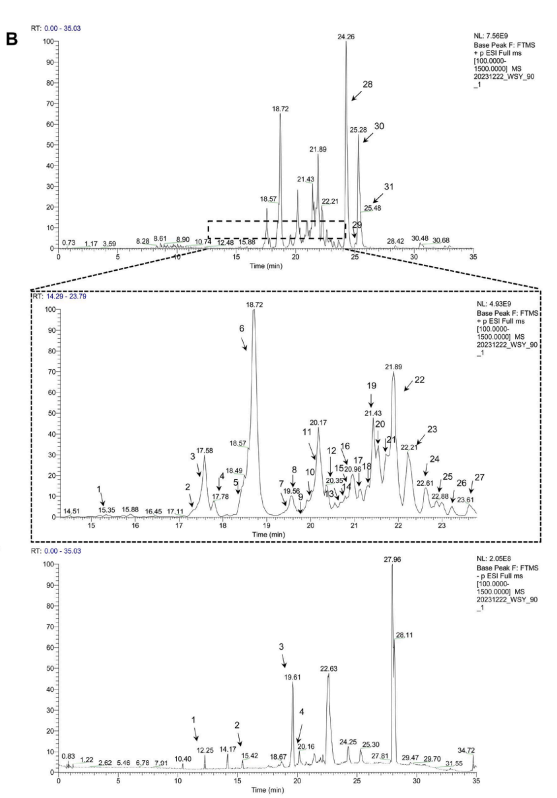
图2 LSC的主要化学成分。(A) LSC的HPLC图谱;(B) LSC底峰色谱图;(C)所有鉴定化合物的结构;(D)特征结构的质谱破碎图。

图3 LSC可减轻MPTP诱导小鼠的病理表型。(A)研究设计方案图;(B) MPTP 小鼠爬杆和转杆行为数据;(C)TH阳性神经元代表图像;(D) Nissl染色阳性神经元结果;(E)各组TH、相对α-syn蛋白WB分析;(F) LSC提取物处理BV-2细胞株的细胞活力及LSC对BV-2细胞NO释放的抑制作用。数据以平均值±SEM表示。*, #p < 0.05, **p < 0.01;*表示模型组与其他组比较的p值,#表示对照组与模型组比较的p值。
行为学实验表明,MPTP诱导的PD小鼠与正常组比较行为缓慢,引起一定程度运动障碍;此外,免疫组化与尼氏染色结果均表明LSC可有效改善MPTP小鼠神经元损伤程度,WB结果为LSC有效减轻MPTP诱导的PD小鼠TH减少和多巴胺能神经毒性的结论提供了补充证据。通过CCK-8检测评估LSC对BV2细胞存活的影响。如图3F所示,LSC浓度低于200 μg/ml时没有明显的细胞毒作用。后续实验采用LSC剂量在10 ~ 200 μg/ml。结果表明,与对照组相比,LPS处理后NO的数量显著增加。
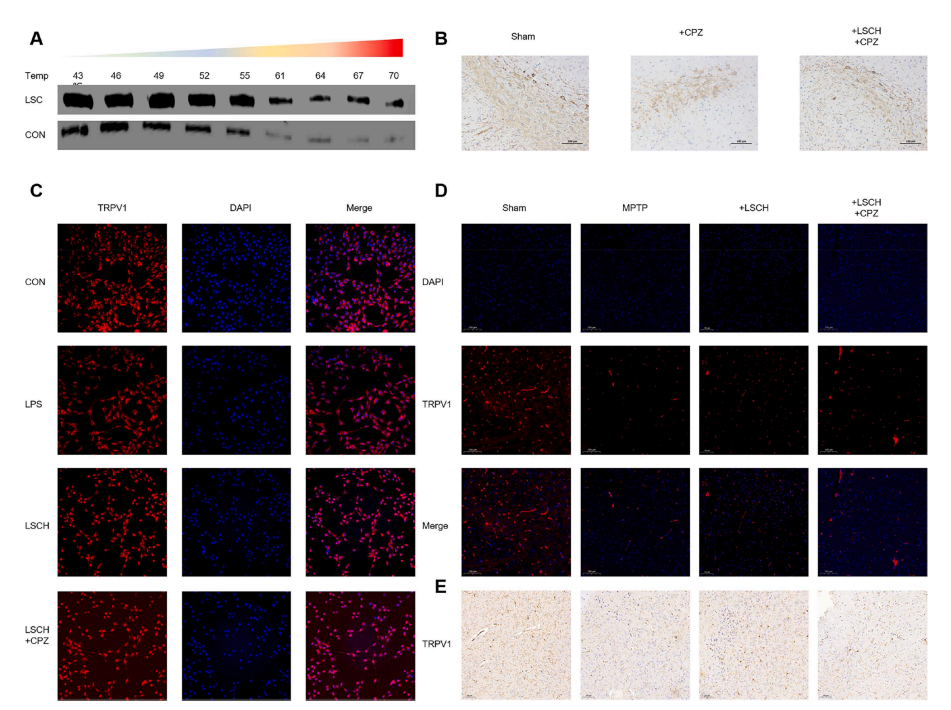
图4 LSC靶向TRPV1发挥抗PD作用。(A) CESTA分析;(B)体外TRPV1的IF分析;(C) TH与CZP的免疫组化分析;(D)体内TRPV1的IF分析。
为了确定LSC对有或没有TRPV1的神经保护作用的具体影响,进行了CETSA分析,证实与对照组相比,LSC治疗在保护TRPV1蛋白完整性免受温度诱导降解方面表现出优越的疗效。IF和IHC分析均显示,LSC处理的MPTP小鼠中TRPV1表达显著上调,表明行为可能有所改善。如图4D和E所示,CZP预处理几乎逆转了这种改善,这些发现表明TRPV1是LSC治疗改善PD小鼠病情的有希望的靶点。TRPV1的激活与线粒体内Ca2+浓度升高和随后的线粒体去极化有关,因此考察了自噬相关指标:与正常组相比,MPTP诱导的PD大鼠自噬底物蛋白p62水平升高(p < 0.05), LC3B/LC3A水平降低(p < 0.05),阐明了LSC通过TRPV1促进MPTP诱导的PD小鼠线粒体自噬的潜在机制。
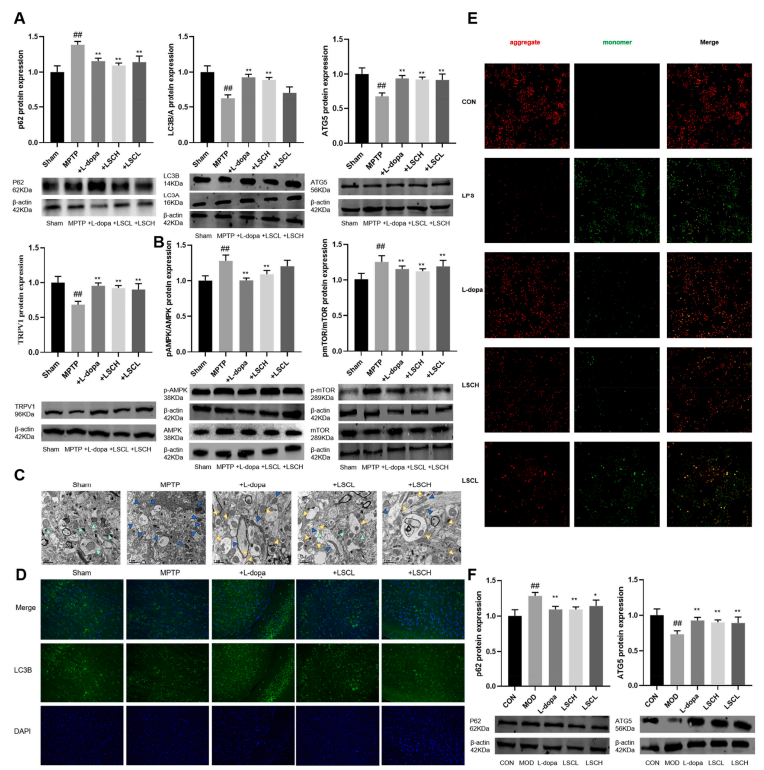
图5 LSC通过AMPK/mTOR通路激活MPTP诱导的小鼠线粒体自噬。(A) TRPV1、ATG5、LC3B/LC3A、p62蛋白的表达;(B) p-mTOR/mTOR和p-AMPK/AMPK蛋白的表达;(C)透射电镜观察PD小鼠神经自噬体;(D) LC3B水平;(E) LSC处理后LPS-BV2细胞线粒体膜电位的变化;(F) BV-2细胞ATG5、p62蛋白的表达。数据以平均值±SEM表示。*, #p < 0.05, **p < 0.01;*表示模型组与其他组比较的p值,#表示对照组与模型组比较的p值。
在MPTP诱导小鼠中,利用IF检测黑质中自噬体标志物LC3B来研究LSC与自噬之间的潜在相关性。给药LSC导致LC3B浓度高于MPTP动物(图5D)。脑切片进行TEM测试,以进一步评估LSC对自噬体激活的影响(图5C)。脑切片进行TEM测试。研究结果表明,在接受LSC治疗的MPTP治疗的动物中,自噬体的产生程度升高,其中功能失调的线粒体位于内部,需要去除。本研究表明,LSC通过TRPV1介导的机制诱导PD小鼠自噬,可促进自噬底物的减少。
在LPS-BV2细胞中检测自噬相关蛋白的表达。LSC治疗增加了LPS-BV2细胞的线粒体膜电位,但与阳性药物相比,影响无统计学意义(图5E)。LSC处理显著增强LPS-BV2细胞线粒体膜电位。同时,LSC处理显著改变了LPS-BV2细胞中ATG5/p62的表达(图5F)。结果表明,LSC处理可导致小胶质细胞自噬通量升高。
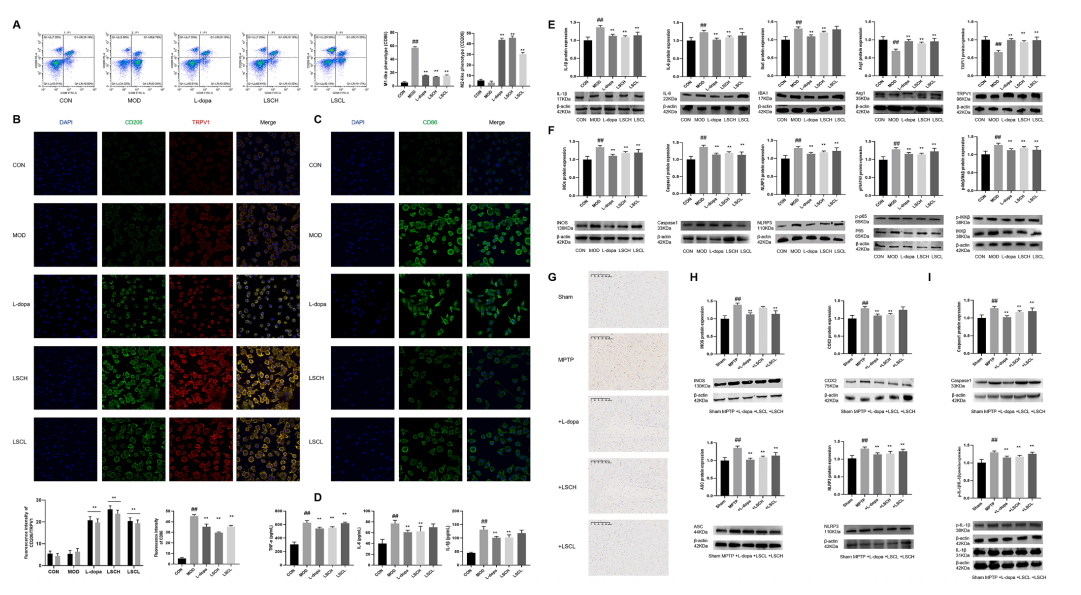
图6 LSC促进LPS诱导的BV2细胞从M1型到M2型转变抑制神经炎症。(A)流式细胞术检测LSC对LPS诱导BV2细胞CD206 / CD86蛋白表达的影响;(B-C) LSC通过IF对LPS诱导的BV2细胞CD206、TRPV1和CD86蛋白表达的影响;(D) Elisa法检测IL-1β、IL-6、TNF-α蛋白的表达;(E)采集全细胞,检测IL-1β、IBA-1、IL-6、Arg1、TRPV1、iNOS蛋白表达;(F)采集全细胞,检测p65、p-pp65、IKKβ、p-IKKβ、NLRP3、caspase1的蛋白表达;(G)脑组织IBA1阳性神经元代表图像;(H)脑内COX2、iNOS蛋白表达;(I)脑蛋白IL-1β、p-IL-1β、NLRP3、ASC、caspase1的表达。数据以平均值±SEM表示。*, #p < 0.05, **p < 0.01;*表示模型组与其他组比较的p值,#表示对照组与模型组比较的p值。
利用流式细胞术和免疫荧光检测CD86(代表M1极化)和CD206(代表M2极化)水平,以评价LSC的神经保护特性与BV2细胞极化的相关性。采用WB或ELISA定量测定LPS作用下TNF-α、IL-1β、IL-6、iNOS、IBA-1、TRPV1和Arg-1的产生。结果显示,在LPS刺激下,M1促炎细胞因子的产生显著增加,LSC抑制了LPS引起的M1促炎细胞因子,同时增加了M2抗炎因子的表达。
总结
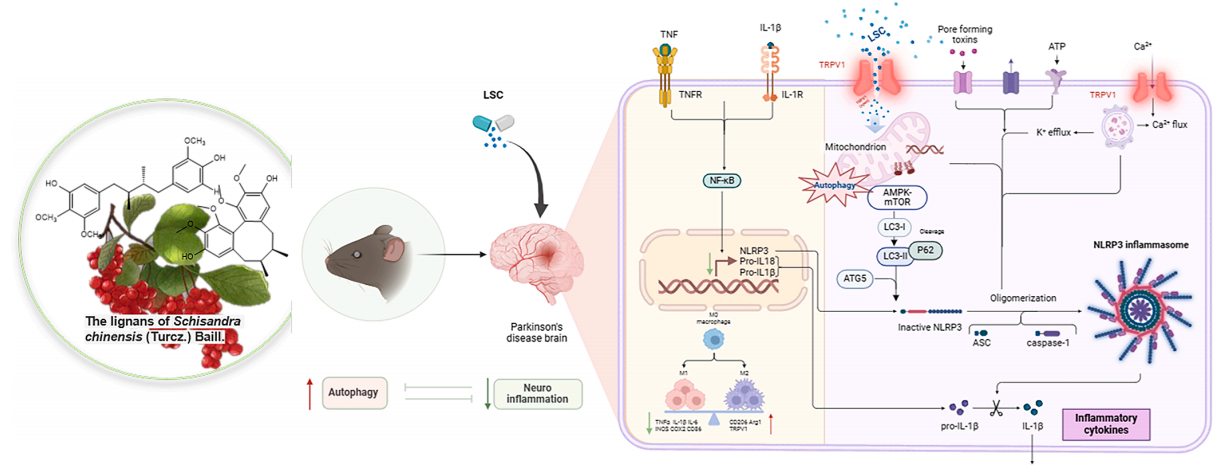
图7 LSC对PD神经炎症保护作用的潜在机制示意图。
网络药理学及前人研究表明,五味子木脂素与TRPV1有高度相关性,TRPV1降低可加速PD。小胶质细胞中TRPV1的激活可以诱导自噬,促进α-突触核蛋白的清除,减轻神经炎症,最终改善PD的治疗。研究结果表明,LSC通过抑制AMPK/mTOR蛋白磷酸化诱导TRPV1活化,导致自噬标志物(ATG5/p62/LC3)的改变,这些结果与先前的研究一致。同时,LSC刺激小胶质细胞的自噬过程,促进细胞溶酶体内有害蛋白的分解。
本研究表明,LSC通过调节TRPV1,激活AMPK-NLRP3信号通路,减轻MPTP诱导的PD小鼠和LPS刺激的BV2细胞的神经炎症,从而增强自噬。该研究首次利用PD的细胞和动物模型来评估LSC的保护功能及其潜在过程。此外,目前针对TRPV1的LSC的研究是有效刺激自噬和抑制炎症以增强PD相关症状的初步研究。同时,本研究利用多种方法研究LSC如何通过AMPK-mTOR- NLRP3介导的靶点TRPV1调节PD的自噬炎症。这证实了抑制TRPV1导致PD发展的观点,并证明LSC靶向TRPV1是科学研究中治疗PD的一种有前景的方法。