2024年12月4日,太行本草研究院师生在科研楼202会议室开展组会学习,本次由2023级硕士研究生陈健进行“具有底物混杂性和催化区域特异性的管花肉苁蓉丙二酰基转移酶的分子特征和结构基础”文献精读。

背景介绍
天然糖苷是药物先导物的可靠来源。这些化合物的糖部分通常以酰化形式存在,包括乙酰化、香豆酰化、咖啡酰化、阿魏酰化等,其中丙二酰化是自然界中最常见的脂肪酰化形式之一。取代在糖部分的丙二酰基对于稳定不稳定结构,改变亲脂性等非常重要。近年来,丙二酰化糖苷因其重要的生理和理想的药物作用在植物生理学和药物发现领域越来越受到重视。
然而,从天然材料中提取和分离的耗时和高成本在很大程度上限制了它们的可用性。另一方面,由于产物的特异性和不可预测性较差,阻碍了糖单元上的选择性化学酰化。相比之下,酶法酰化法由于其催化效率高、区域选择性强、反应条件温和、过程可控等优点,作为一种替代。
负责丙二酰化的酶为丙二酰基转移酶。该酶主要以丙二酰CoA为酰基供体,对多种芳香化合物进行转酰基化反应。花青素和黄酮类化合物是报道最多的丙二酰基转移酶受体。
肉苁蓉是一种富含苯乙醇苷(PhGs)的传统药材,其糖苷通常被不同的酰基取代基修饰,如乙酰基、香豆酰基等。在本文中,为了探索新的具有活性的糖苷酰基转移酶在酶促酰化反应中的应用,从管花肉苁蓉中扩增出一种新的丙二酰基转移酶CtMaT1,并对其进行了功能表征。
结果与讨论

图1 CtMaT1和其他已报道的丙二酰转移酶氨基酸序列的多重比对

图2 CtMaT1与其他BAHD家族酰基转移酶的系统发育分析。CtMaT1位于进化支I中(黄色背景),用红星标记。
作者对管花肉苁蓉的转录组进行了测序,并对转录组进行了生物信息学分析,包括多重序列比对(图1)和系统发育分析(图2)等,从管花肉苁蓉中获得了一个丙二酰基转移酶候选基因CtMaT1基因并发现其具有潜在的多功能性。
随后在大肠杆菌中表达CtMaT1,通过镍螯合亲和层析纯化获得重组蛋白,并对重组蛋白进行功能验证。
首先进行体外功能验证。将CtMaT1与供体,底物在一定温度,pH下进行酶促反应,通过HPLC、HRESI-MS分析产物。

图3 CtMaT1对矢车菊素-3-O-葡萄糖苷(1)丙二酰化反应的HPLC色谱、紫外光谱和HRESI-MS光谱
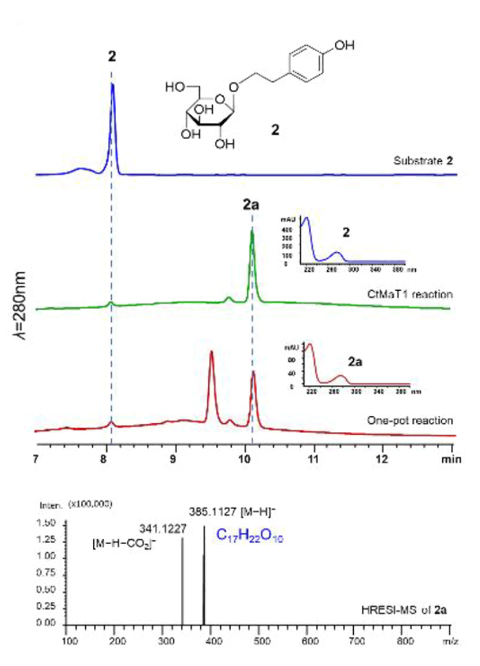
图4 CtMaT1对红景天苷(2)的丙二酰化反应的HPLC紫外和HRESI-MS光谱。
首先对酶促反应体系中的底物进行分析。选取矢车菊素-3-O-葡萄糖苷(一种常见的花青素)作为初始酰基受体。结果显示出了丙二酰化花青素的特征质谱(图3)。为了评估 CtMaT1 对其他糖苷的酰化能力,以醇苷红景天苷(2)作为受体底物。结果显示出了丙二酰化红景天苷的特征质谱(图4),表明了 CtMaT1 具有多功能性。
为了进一步探索CtMaT1的酰基受体耐受性,构建了一个受体文库,该文库包含84种结构不同的底物和天然产物中发现的各种支架(图5)。
对文库所有化合物进行处理,并进行高效液相-紫外可见光谱和高分辨质谱分析。结果发现,CtMaT1表现出前所未有的底物混杂性。
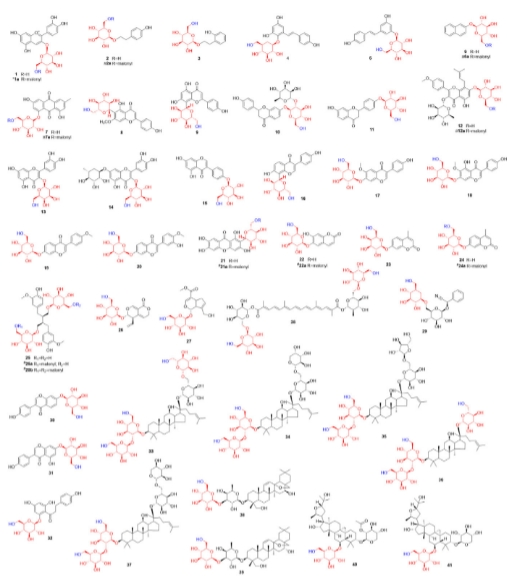
图5 底物1-41的化学结构
对CtMaT1所催化的底物进行总结,发现其分为五点。1.CtMaT1对多种糖苷的丙二酰化活性不受糖基类型或取代模式的限制。2.对于糖部分类型,CtMaT1对糖苷表现出高选择性。含有半乳糖基的底物也能被接受,但活性相对较弱。3.CtMaT1还可以催化二丙二酰化反应。4.CtMaT1不接受对应的苷元,糖基对CtMaT1的活性至关重要。5.CtMaT1在葡萄糖链的C6-OH位置具有高区域特异性,催化单丙二酰化和二丙二酰化。
对酶促反应体系中的供体进行分析。发现CtMaT1可以接受丙二酰CoA,甲基丙二酰CoA作为酰基供体,而不接受阿魏酰CoA,乙酰CoA等。这进一步证明了CtMaT1为丙二酰基转移酶。
最后,对酶促反应体系中的最适pH,温度等进行探究。研究发现CtMaT1的最适pH值为6.0,最适温度为30℃,转化率在5h之后达到最高,并且酶活性不受二价金属离子的影响。
以上是对CtMaT1体外功能的探究。
接下来对CtMaT1的体内功能进行探究。将CtMaT1通过农杆菌渗透进一步在本氏烟草中表达。添加矢车菊素-3-O-葡萄糖苷和丙二酰基CoA后,产物积累并通过HPLC和HRESI-MS进行分析,与体外反应中的产物1a相比具有相同的保留时间和质谱,这证实了CtMaT1具有酰基转移酶的活性。
酶的结构是其功能和活性的基础。CtMaT1具有显著的催化活性,促使我们对其结构进行深入的探究。
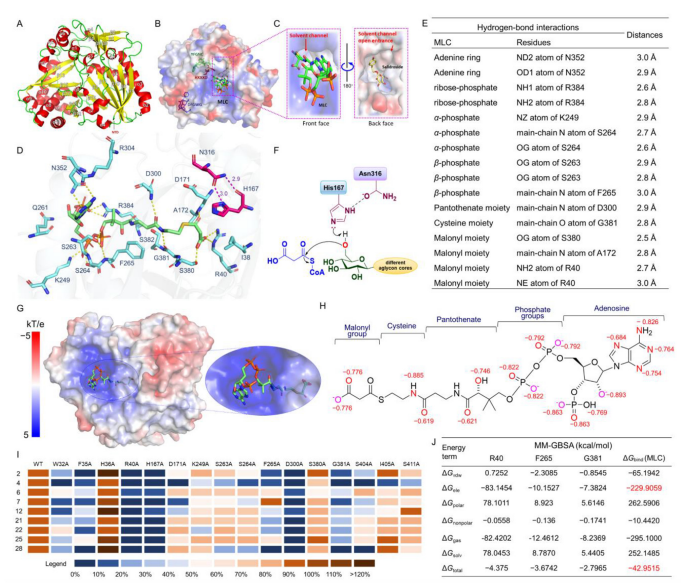
图6 CtMaT1的蛋白质结构预测、对接和突变研究。(A)CtMaT1的整体结构。α-螺旋、β-折叠和环分别以红色、黄色和绿色显示;(B)CtMaT1与供体和红景天苷对接的表面展示突出了HxxxD、DFGWG和YFGNC的保守基序,分别以红色棒、蓝色棒和绿色棒显示;(C)CtMaT正面(左)的供体结合口袋和背面(右)的酰基受体结合口袋的放大视图;(D)供体结合口袋中关键残基的对接结果。供体和关键残留物分别以绿色和蓝色棒状存在。供体和CtMaT1之间的氢键显示为黄色虚线;(E)供体与关键残基之间的相互作用细节,用于识别酰基供体;(F)由残基H167和N316进行的CtMaT1的SN2催化反应机理;(G)CtMaT1表面的静电势。电负区、中性区和正电区分别以红色、白色和蓝色表示;(H)计算了供体的RESP模型电荷。标记了带负电荷值的原子;(I)以供体为酰基供体,对底物2、4、6、7、12、21、22、25和28进行CtMaT1的定点突变研究;(J)MM/GBSA计算了CtMaT1-供体络合物的结合自由能值和前三个贡献残基的分解能值。
在CtMaT1的三级结构中共发现了11个α-螺旋和18个β-链,形成了两个相互作用的α/β混合子结构域(图6A)。保守的DFGWG基序远离活性口袋,可能有助于支持蛋白质的构象维持。HxxxD基序和YFGNC基序位于界面旁边,有助于建立中心溶剂通道(图6B、C)。
供体结合口袋与中心溶剂通道相连。与供体相互作用的关键残基大部分为亲水性氨基酸(图6D)。值得注意的是,在CtMaT1的供体口袋中总共观察到16个氢键相互作用(图6E)。突变体R40A和D300A诱导CtMaT1对所有测试底物的催化活性显著降低,为R40和D300在供体接受中不可替代的作用提供了生物活性证据。突变体G381A对不同底物的活性明显降低。对酰基供体结合袋中的其他残基进行丙氨酸扫描诱变,也会导致CtMaT1的催化活性明显降低(图6I),突出了它们在供体识别中的重要作用。
此外,为了支持丙二酰基化对不同糖苷的耐受性,预测CtMaT1与供体具有很强的结合亲和力。基于MM/GBSA的结合自由能计算证实了这一假设。计算得到CtMaT1-供体配合物中供体的结合自由能为42.9515 kcal/mol,其中静电相互作用的贡献很大(图6J)。CtMaT1在供体结合口袋中表现出显著的电正性,而去质子化的供体则具有主要的负电荷(图6G、H)。这就合理解释了反电荷的分布可以引起一个有吸引力的势场,从而增强供体与CtMaT1的结合亲和力。
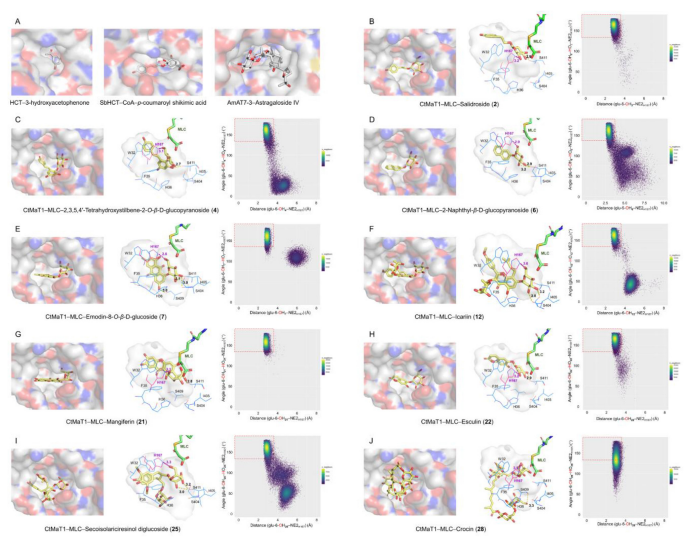
图7 (A)HCT、SbHCT和AMAT7-3的底物结合口袋表面。(B-J)CtMaT1酰基受体结合部位不同底物(2、4、6、7、12、21、22、25和28)的代表性构象(左柱),以及通过MD模拟观察到的周围残基(中柱)及其对应的构象图(右柱)。供体和底物分别以绿色和黄色棒状存在。在PyMOL中计算并生成了显示为白色表面的酰基-受体结合口袋。周围的残留物用蓝色线条表示。H167显示为洋红色线条。氢键用短划线表示。在RStudio制作的地图中,填充最多的构象显示为黄色,填充最少的构象显示为蓝色。催化构象区域显示在红色方框中。
为了解释CtMaT1对各种糖苷的底物耐受性,选择了9种具有不同糖苷元骨架的糖苷底物进行对接和动态模拟研究。对接结果表明,酰基受体结合口袋通过中心溶剂通道与供体结合口袋相连。最近,从黄芪中鉴定出一种乙酰转移酶AmAT7-3,可以利用黄芪甲苷IV作为乙酰受体。与其他已报道的酰基转移酶相比,它具有显著增大的底物口袋,能够容纳大尺寸的皂苷分子。CtMaT1显示出与AmAT7-3相当的底物结合袋,明显大于具有已知底物结合口袋的结构(图7A)。CtMaT1的酰基受体口袋在所有三个维度上都显示出足够的尺寸,使得内部口袋足够大,可以容纳不同尺寸的不同糖基核的各种糖苷底物(图7B-J)。
为了探究CtMaT1在不同底物6-OH位置上的高丙二酰化区域选择性,对9种配合物进行了模拟,并分析了结果轨迹。研究发现无论底物的空间几何形状如何,它们的糖部分始终位于H167残基附近。H167的咪唑官能团位于酰基供体和酰基受体口袋之间,靠近供体的丙二酸酯部分和糖苷底物的糖基羟基(图6D、图7)。作为植物ATs中高度保守的催化残基,H167被认为是引发SN2转移反应的碱催化剂(图6F)。H167的诱变导致对所有底物的活性显著受损,表明其在丙二醛化过程中起重要作用。动态模拟后的9种三元配合物的代表性构象一致显示,每种情况下H167残基与葡萄糖的6-OH基团之间都形成了氢键,并且这些相互作用在整个模拟过程中都是高度稳定的。这些构象支持丙二醇基部分通过SN2机制转移到葡萄糖部分的6-OH位置,从而合理解释了CtMaT1的区域特异性。
为了考察其对糖苷底物的偏好,对基于两种异构体化合物的两种反应模型进行了QM/MM计算:4-甲基伞形基-β-D-半乳糖苷(23)和4-甲基伞形基-β-D-吡喃葡萄糖苷(24)。23和24都具有相同的苷元,唯一的区别在于它们的糖链;具体来说,23是半乳糖苷,而24是葡萄糖苷。计算结果表明MU-Glc配合物的TS1和TS2的能量明显低于MU-Gal配合物。这些结果表明,MU-Glc通过糖基羟基单元去质子化的丙二醇转移过程比MU-Gal容易得多,这与CtMaT1对糖苷的明显偏好的实验观察结果一致(图8)。
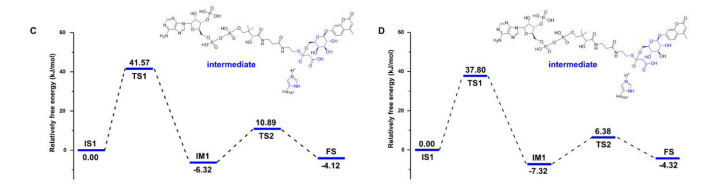
图8 (C-D)计算了CtMaT1-供体-23三元配合物(C)和CtMaT1-供体-24三元配合物(D)的能量分布。能量以千焦/摩尔为单位。
从诱变研究中,获得一个突变体H36A,它可以大大增加二丙二酰化产物的形成。为了阐明增强的二丙二酰化的机制,采用单丙二酰化产物25a作为酰基受体,建立了三元配合物CtMaT1 (WT)-供体-25a(WT complex)以及CtMaT1(H36A)-供体-25a(H36A complex)的三元复合物进行MD模拟。
研究发现,在WT配合物中,除了H167的氢键外,还有另外三个氢键和四个疏水相互作用。然而,当组氨酸36被丙氨酸取代时,25a丙二酰基部分的羧基氧原子与H36残基之间的氢键被破坏。同时为25a结合提供了更多的空间,使得25a的构象发生变化,从而与残基G407、E408、S409、Y371、S380和S411形成6个新的氢相互作用。此外,还有4种疏水相互作用和一个堆积作用。这些相互作用有效地促进了二丙二酰化反应。
为了更深入地了解突变体H36A二丙二酰化活性的提高,分别用MM/GBSA方法计算了WT配合物和H36A配合物催化构象的结合自由能,以及每残基结合能的贡献。
WT复合物和H36A复合物中每个残基的结合能谱在大多数区域显示出高度的相似性,在WT复合物中能量贡献适中的残基I405到S411周围观察到显著的变化。然而,在H36A配合物中,I405、G407、S409和S411的能量贡献显著,这与上述观察到的H36A配合物中25a的构象变化相对应,从而导致25a与I405至S411残基区产生新的相互作用。此外,Y371的分解结合自由能值高于WT配合物,也证实了25a与Y371之间所发生的氢相互作用。最后确定WT配合物和H36A配合物催化构象的总结合自由能分别为36.3666和52.7984 kcal/mol。在H36A复合物中观察到的结合自由能降低,为突变体的二丙二酰化活性增强提供了更有力的证据(图9)。
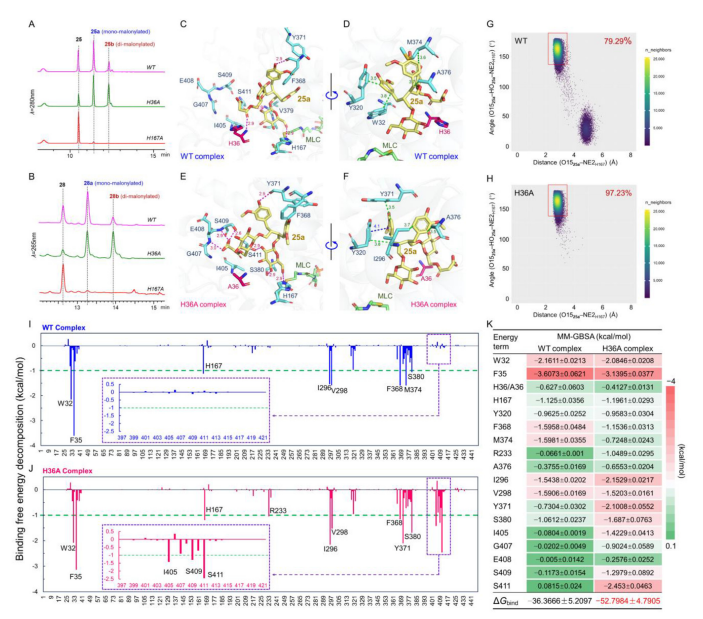
图8 CtMaT1二丙二酰化活性增强的分子机制。(A-B)分别由野生型(WT)CtMaT1、突变体H36A和H167A催化底物25(A)和28(B)的单丙二酰化反应的高效液相色谱图;(C-F)分别由野生型(WT)-供体-25a(C,D)和H36A-供体-25a(E,F)催化的具有代表性的三元络合物。底物25a显示为黄色线条。相互作用的残基显示为青色棒。残基H36或A36显示为洋红棒。氢相互作用、疏水相互作用和p堆积相互作用分别被标记为洋红、绿色和蓝色虚线;WT-供体-25a络合物(G)和H36A-供体-25a络合物(H)在MD模拟过程中的构象图。填充最多的构象显示为黄色,填充最少的构象显示为蓝色。催化构象区域显示在红色框中;(I-J)WT络合物(I)和H36A络合物(J)的全残基结合自由能贡献曲线。(K)MM/GBSA计算了WT络合物和H36A络合物的结合自由能值,以及涉及的关键残基的分解能值。
所获得的9种新的丙二酰化糖苷的药理学活性使用主要基于底物活性报道选择的测试模型进行评估。在自由基清除活性的评估中获得了有趣的发现。以Trolox为阳性对照,在50 mmol/L(终浓度)条件下测定化合物2a、21a、25a和25b及其未修饰的2、21和25型对DPPH自由基的作用。有趣的是,研究发现单丙二酰化糖苷21a、25a和二丙二酰化糖苷25b对DPPH自由基的清除率远高于阳性对照Trolox。此外,与它们的原始对偶物21和25相比,引入丙二酰基导致生物活性增强。DPPH自由基清除活性可以直接反映化合物的抗氧化能力。21a、25a和25b具有良好的DPPH自由基清除能力,预示着它们作为抗氧化剂的发展前景