2024年12月11日,太行本草研究院师生在科研楼202会议室开展组会学习,本次由2022级硕士研究生穆丽芬进行“复方苦参汤通过调节notch信号通路增强小鼠右旋糖酐”文献精读。

背景介绍
复方苦参汤(CSD)是一种中草药汤剂,临床上常用于以血性腹泻为特征的溃疡性结肠炎(UC)患者。然而,复方起作用的潜在机制尚不清楚。方法:采用含3%右旋糖酐硫酸钠(DSS)的标准日粮,同时口服CSD治疗C57BL/6 J小鼠实验性结肠炎。每天记录粪便、体重等临床症状,观察结肠长度及其组织病理学变化。采用cleaved caspase-3蛋白表达检测结肠上皮细胞凋亡,Ki-67免疫组化检测细胞增殖。透射电镜和免疫荧光法检测ZO-1、occludin等紧密连接复合体。测定fitc-葡聚糖4000的浓度,评价肠屏障通透性,探讨可能的信号通路。western blot检测MUC2和notch通路的表达。流式细胞术检测大鼠脾脏和肠系膜淋巴结M1/M2比值。采用qRT-PCR检测iNOS和Arg1 mRNA水平。CSD能明显减轻临床表现和病理损害。改善结肠炎小鼠的体重减轻和DAI评分,抑制结肠缩短。CSD能够减少上皮细胞凋亡,促进上皮细胞再生。dss诱导的结肠炎小鼠肠道通透性增加减少。此外,CSD处理明显上调ZO-1和occludin的表达及MUC2的分泌,调节notch信号,降低M1/M2比值。这些数据共同表明,CSD至少部分通过调节dss诱导结肠炎小鼠的notch信号通路,有效减轻肠道炎症,促进巨噬细胞表型改变,增强结肠黏膜屏障功能。
结果与讨论
背景介绍
复方苦参汤(CSD)是一种中草药汤剂,临床上常用于以血性腹泻为特征的溃疡性结肠炎(UC)患者。然而,复方起作用的潜在机制尚不清楚。方法:采用含3%右旋糖酐硫酸钠(DSS)的标准日粮,同时口服CSD治疗C57BL/6 J小鼠实验性结肠炎。每天记录粪便、体重等临床症状,观察结肠长度及其组织病理学变化。采用cleaved caspase-3蛋白表达检测结肠上皮细胞凋亡,Ki-67免疫组化检测细胞增殖。透射电镜和免疫荧光法检测ZO-1、occludin等紧密连接复合体。测定fitc -葡聚糖4000的浓度,评价肠屏障通透性,探讨可能的信号通路。western blot检测MUC2和notch通路的表达。流式细胞术检测大鼠脾脏和肠系膜淋巴结M1/M2比值。采用qRT-PCR检测iNOS和Arg1 mRNA水平。CSD能明显减轻临床表现和病理损害。改善结肠炎小鼠的体重减轻和DAI评分,抑制结肠缩短。CSD能够减少上皮细胞凋亡,促进上皮细胞再生。dss诱导的结肠炎小鼠肠道通透性增加减少。此外,CSD处理明显上调ZO-1和occludin的表达及MUC2的分泌,调节notch信号,降低M1/M2比值。这些数据共同表明,CSD至少部分通过调节dss诱导结肠炎小鼠的notch信号通路,有效减轻肠道炎症,促进巨噬细胞表型改变,增强结肠黏膜屏障功能。
结果与讨论

图2。CSD可减弱dss诱导损伤。(A) UC模型及药物治疗示意图。(B)体重变化。(C)结肠长度统计。(D)冒号的代表性照片。(E) DAI评分。(F)基于HE染色法的组织学评分。(G)HE染色(放大×200)。数据以mean±SD表示。* p < 0.05, ** p < 0.01, *** p < 0.001, **** p < 0.0001,与DSS组比较。
DSS组体重减轻,DAI评分明显较高,结肠较短;CSD中、高剂量及美沙拉嗪治疗后显著改善小鼠体重减轻;DAI评分明显降低;结肠较模型组相比增长。
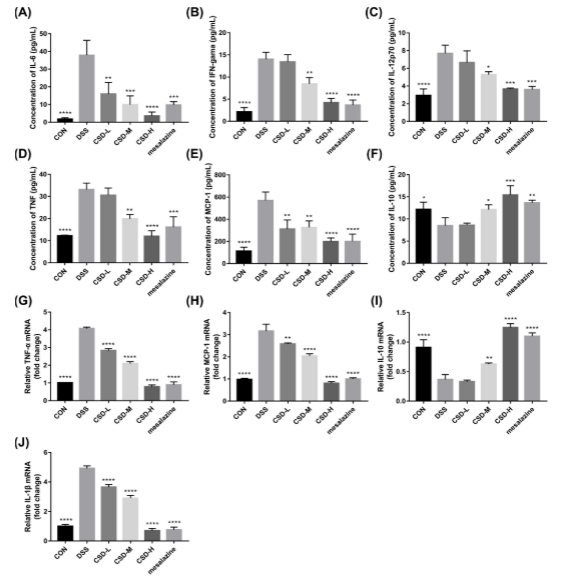
图3。CSD影响dss诱导结肠炎小鼠促炎和抗炎细胞因子的产生。采用CBA小鼠炎症试剂盒检测各组细胞因子IL-6 (A)、IFN-γ (B)、IL-12p70 (C)、TNF (D)、MCP-1 (E)、IL-10 (F)的蛋白表达水平,采用qRT-PCR检测TNF-α(G)、MCP-1 (H)、IL-10 (I)、IL-1β (J) mRNA表达水平。数据以三个独立实验的平均值±SD表示。* p < 0.05, ** p < 0.01, *** p < 0.001, **** p < 0.0001,与DSS组比较。
DSS组体重减轻,DAI评分明显较高,结肠较短;CSD中、高剂量及美沙拉嗪治疗后显著改善小鼠体重减轻;DAI评分明显降低;结肠较模型组相比增长。
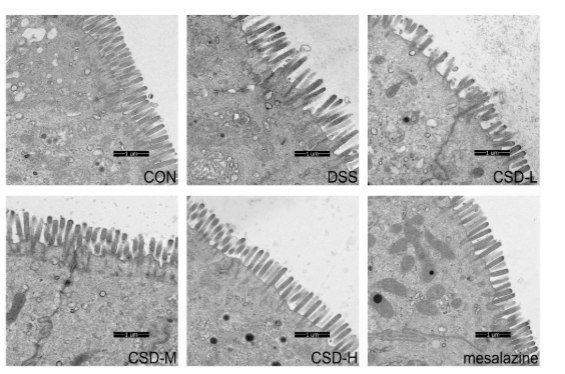
图4。不同处理小鼠结肠段的电子显微图像。各组鉴定如下图所示。比例尺=1 μm。
正常组:微绒毛结构正常,紧密连接( TJs )在微绒毛的正下方是狭窄和完整的。与此相反,DSS灌胃小鼠的紧密连接和微绒毛超微结构发生了显著变化。CSD可以改变这种情况。
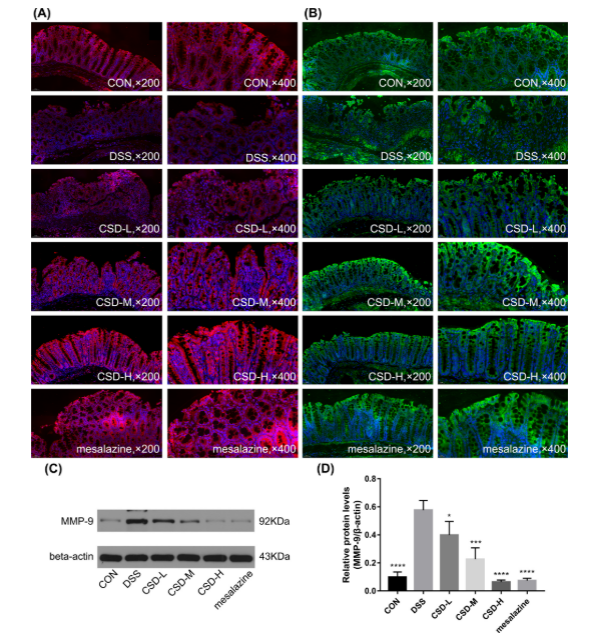
图5。口服DSS后,CSD通过抑制小鼠MMP-9的表达来保护紧密连接。ZO-1 (A)和occludin (B)免疫荧光染色合并图。(C) MMP-9的代表性免疫印迹图。(D) MMP-9的定量分析。
基质金属蛋白酶9 (MMP-9)与细胞外基质( ECM)的降解和重塑密切相关,并调节ECM的稳态。CSD和美沙拉嗪可恢复ZO-1、occludin这两种蛋白的再分配和耗竭。
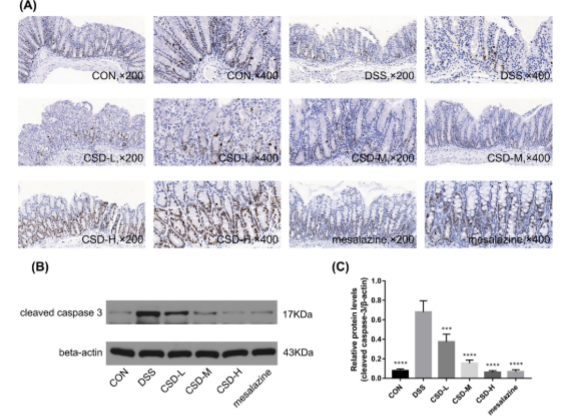
图6。CSD通过确保增殖-凋亡平衡介导保护作用。(A)结肠样品中Ki67免疫组化染色。(B) western blot检测活性caspase-3。(C)活性caspase-3的定量分析。数据用三个独立实验的平均值±SD表示。* p < 0.05, ** p < 0.01, *** p < 0.001, **** p < 0.0001,与DSS组比较。
CSD可以保护小鼠免受dss诱导的结肠炎,并伴有Ki67阳性细胞计数明显增加。CSD可显著抑制炎症肠道中caspase-3的活性表达。
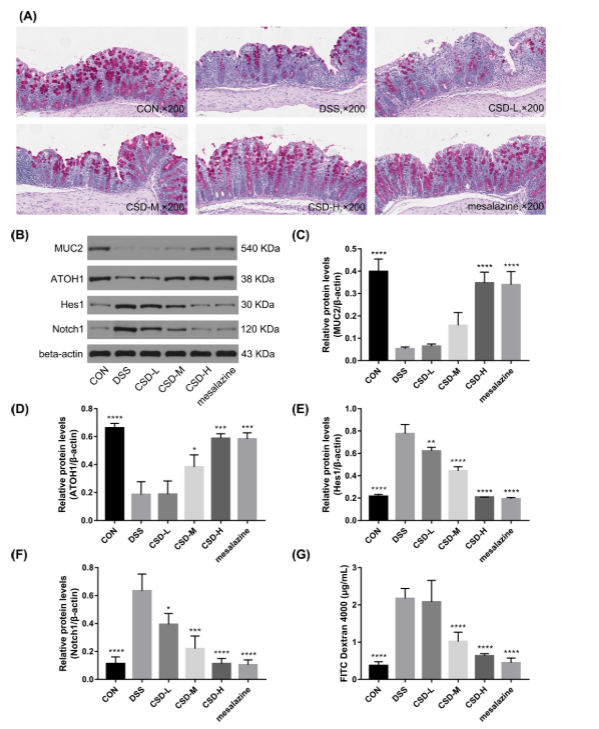
图7。CSD通过增强黏液层屏障功能改善dss诱导的上皮通透性。(A)结肠切片黏液的PAS染色。(B)小鼠结肠MUC2、ATOH1、Hes1和Notch1的免疫印迹分析。MUC2 (C)、ATOH1 (D)、Hes1 (E)、Notch1 (F)的定量分析。(G)肠通透性测定。数据以三个独立实验的平均值±SD表示。* p < 0.05, ** p < 0.01, *** p < 0.001, **** p < 0.0001,与DSS组比较。
高剂量组和美沙拉嗪可显著降低巨噬细胞M1 / M2的比例。一氧化氮合酶(iNOS, M1特异性标记)的mrna水平下调,而M2表型标志基因精氨酸酶1 (Arg-1)水平升高。

图8。口服CSD促进组织巨噬细胞的促炎状态的消退。采用qRT-PCR检测脾脏M1 (F4/80+CD11b + CD86+)和M2 (F4/80+CD11b + CD206+)的比例(A)和MLNs (B),并检测iNOS (C)和Arg-1 (D) mrna表达。数据以三个独立实验的平均值±SD表示。* p < 0.05, ** p < 0.01, *** p < 0.001, **** p < 0.0001,与DSS组比较。
PAS染色:给药后,杯状细胞和相关粘液增加。CSD可以促进小鼠结肠上皮细胞屏障缺陷和粘液屏障受损的恢复,从而降低肠道通透性。
讨论
虽然UC的发病机制尚不明确,但积累的证据表明,引起UC的因素可能是环境刺激、肠道菌群改变、肠道屏障缺陷和遗传易感性。导致存在于肠上皮下的不受控制的免疫激活,与过度的粘膜炎症相关。虽然临床上治疗UC的药物在一定程度上得到了缓解,但治疗反应、耐受性和副作用的局限性不容忽视,因此需要寻找替代或辅助途径。CSD是一种由六种成分组成的中药,在临床实践中已被证明是有效的。我们前期研究证实,CSD可改善dss诱导的UC及相关结直肠癌。采用高效液相色谱-质谱联用及薄层色谱法对处方中的10个成分进行鉴定,主要为苦参碱、氧化苦参碱、没食子酸、甘草素、甘草酸、人参皂苷Rb1、三七皂苷R1、靛蓝、靛玉红、白芨。氧化苦参碱是苦参提取物的主要有效成分,经研究证实,其作用机制为抗炎、促凋亡、抑制Th1和Th17细胞的分化,从而显著减轻dss诱导的结肠炎PI3K/AKT信号通路。白芨多糖不仅能促进肠道黏膜的再生,还能通过抑制TNF-α和NF-κ b,上调IL-10,调节UC小鼠的免疫系统平衡和炎症反应。有证据表明,白芨多糖加入灌肠剂具有良好的黏膜保护作用,可在肠黏膜表面形成凝胶,增强制剂与肠壁的粘连,从而提高肠道局部药物浓度。没食子酸在体外和体内通过抑制NF-κB通路,增加IL-4、IL-10等抗炎因子的表达,减少IL-1、IL-6、IL-12、IL-17、IL-23、TGF-β、TNF-α等促炎介质的释放。此外,靛玉红可抑制CD4 + T细胞的浸润,诱导foxp3表达细胞的形成dss诱导UC小鼠结肠中的调节性T细胞。在本研究中,我们发现CSD治疗在临床表现和组织学改变方面取得了令人满意的结果,这与CSD对实验性结肠炎BALB/c小鼠的保护作用的报道一致。CSD尤其是大剂量组对体重减轻、血尿、结肠短缩均有明显改善,本实验采用美沙拉嗪作为阳性对照。从隐窝结构扭曲到固有层淋巴细胞和浆细胞的积累等暗含的病理特征也通过CSD治疗得以恢复。此外,本研究还揭示了CSD预防dss诱导UC的更多潜在机制。完整的肠黏膜屏障由机械屏障、化学屏障、免疫屏障和生物屏障组成,是机体防御的关键。在炎症性肠病(IBD)中,这些一线防御机制中有许多是失调的。UC粘膜屏障的破坏可能会加剧肠道共生微生物和毒素的入侵,随后通过增强不适当的免疫反应发展为慢性炎症。IECs由肠道干细胞衍生而来的4个细胞系组成,是一组异质性单层细胞,相邻上皮细胞之间的空间被顶端连接复合物封闭,形成机械屏障。细胞凋亡增加、跨细胞或细胞旁转运都可能导致上皮屏障通透性的改变。肠上皮屏障破坏损伤和死亡被认为是UC病理生理bb0的标志。与克罗恩病(CD)患者和健康人相比,UC患者的IECs凋亡发生率更高,且隐窝上部的IECs比隐窝下部的更容易发生凋亡。与这些报道一致,我们还发现cleaved caspase-3(一种众所周知的凋亡刽子手蛋白酶)的表达在DSS治疗后增加,表现出与人类UC相似的一些临床和病理学特征。DSS组结肠隐窝中Ki67的表达也明显缺失。然而,CSD可以挽救这些疾病,提示促进IECs的增殖和抑制其凋亡可能是CSD在治疗UC中的保护作用机制之一。以 claudin、occludin、junctional adhesion mole - cules 和 scaffoldprotein zoonula occludins为代表的TJs主要负责调节细胞旁运输,也是上皮细胞构成屏障功能的最主要结构成分。在正常和病理条件下,它们起屏障和栅栏的作用,阻止无数离子和小溶质通过两个相互作用细胞之间的空间自由通过。在组成型活性肌球蛋白轻链ki - nase (MLCK)转基因小鼠中已经证明,肠内上皮内紧密连接功能障碍导致亚临床粘膜免疫激活,其特征是固有层CD4+淋巴细胞的募集或增殖,CD11c +树突状细胞的再分布升高IFN-γ和TNF的粘膜转录,以及上皮MHC I类的产生增强。此外,具有这种细胞旁屏障缺陷的转基因小鼠更容易患病,并表现出免疫介导性结肠炎的严重程度增强。同样,我们的研究数据显示,DSS导致TJs的结构和分布被破坏,ZO-1的表达和闭塞明显降低,临床表现的严重程度要大得多,而上述异常变化在CSD的表现中得到恢复。
据报道,dss诱导的促炎细胞因子参与TJ丢失的发生,不仅直接影响上皮TJ蛋白的表达和分布,而且与IFN-γ协同诱导MLCK和其他调节蛋白。Aveleira和他的同事发现TNF-α降低了TJs的蛋白质和
mRNA含量,并改变了这些紧密连接蛋白的细胞定位,这与NF-κB相关,可以通过抑制因子κB激酶(IKK)的化学抑制剂或抑制因子κB α(i -κBα)的腺病毒过表达来减轻,从而阻止NF-κB的激活[30]。结果表明,中药CSD具有下调细胞因子TNF-a、IL-1β水平的作用。更重要的是,我们实验室之前已经证明,CSD降低了phospho-NF-κB p65的表达。因此,我们推测下调NF-κ bp65磷酸化水平和下游炎症介质可能是CSD抗dss诱导的TJs破坏的机制之一。MMP-9是参与IBD发生发展的主要金属蛋白酶。MMP-9在IBD患者的肠道中高度升高,在dss治疗的小鼠的肠道组织中也获得了类似的结果。这在我们的western blot结果中也得到了验证。MMP-9可以调节TJ蛋白的结构和功能,并在炎症刺激下通过上调MLCK的表达诱导肠道通透性的增加。也有证据表明,MMP-9可能加重UC小鼠肠道炎症并导致IECs破裂。本研究表明,CSD抑制MMP-9的释放,对TJs和IECs具有保护作用。层状黏液层是肠粘膜屏障的另一个重要组成部分,是肠道保护的主要守门人。黏液由杯状细胞产生,通常包含几种主要成分。其中一种是粘蛋白,它使粘液具有凝胶状的特性。黏液有两层系统,在结肠中有内黏液层和外黏液层。内黏液层牢固地附着在上皮上,无法穿透结肠细菌,而外黏液层可溶且松散,为共生微生物产生了首选栖息地。肠内的主要黏液成分是MUC2黏液蛋白。Van等人使用化学诱导的DSS结肠炎模型对基因工程小鼠进行的体内研究显示,肠道中MUC2的缺乏和上皮屏障的破坏导致了自发性结肠炎的发生和持续。在dss诱导的结肠炎小鼠和活动性UC患者中,发现杯状细胞数量减少,黏液层变薄,质量下降,使细菌能够穿透并到达上皮,从而导致肠道炎症。因此,恢复黏液层的厚度和性质以及杯状细胞的数量可能是治疗UC的有效方法。已发表的文献报道,进化保守的Notch信号通路介导细胞命运决定和模式;Notch1和Hes1在肠隐窝中特异性表达;以及对Notch靶点和下游效应物Hes1和Math1的进一步突变分析表明,Notch信号在肠上皮发育和稳态调节中是必需的。典型Notch信号通过将Notch1胞内结构域(NICD)与RBP-Jk结合诱导Hes1的转录激活,Hes1直接结合转录因子Atoh1的5′promoter区域,导致分泌谱系(如杯状细胞[15])Atoh1表达降低,表型基因表达抑制。结果,MUC2的表达也明显降低。本研究还发现,DSS治疗后结肠组织中MUC2蛋白水平下降,而CSD和美沙拉嗪治疗后显著升高。鉴于Notch单点对粘液和杯状细胞的影响,我们进一步检测了相关分子,观察到Notch信号在DSS组中异常激活,这与以前的报告。我们的研究结果表明,CSD可能通过抑制Notch信号传导来防止muc2 /杯状细胞的丢失,从而增强粘液屏障。大量炎性浸润局限于结肠和直肠粘膜和粘膜下是UC的典型病理表现之一。炎症浸润由中性粒细胞、淋巴细胞和巨噬细胞组成,它们穿透肠道屏障,导致溃疡和隐窝脓肿[41]。巨噬细胞是一种异质性和可塑性的细胞群。在UC发育的不同阶段,巨噬细胞由于生态位的动态结构而表现出不同的表型,并发挥不同的功能。巨噬细胞依赖于其表型,是炎症反应的启动/维持和消退/再生过程的重要效应细胞。在诱导型UC b啮齿动物模型中,m2样巨噬细胞被认为具有调节、抗炎和促进愈合的作用。因此,我们推测巨噬细胞表型及时向M2显性转变是否有利于粘膜修复。我们的实验结果发现,已知与M1相关的促炎细胞因子谱在CSD组中表达降低。CSD组M1/M2比值降低,iNOS和Arg1表达水平分别降低和升高。HE染色显示,摄入CSD诱导UC的组织学征象急剧减少。综上所述,我们的观察结果表明,CSD治疗可以促进组织巨噬细胞的促炎状态的解决,加速粘膜愈合,从而促进结肠上皮屏障功能的功能改善。
总结
综上所述,本研究表明,CSD对dss诱导的小鼠结肠炎具有多方面的保护作用,其机制是通过部分调节notch信号通路减轻肠道炎症,恢复结肠屏障功能。